Western blot(WB)是实验室中常见且重要的一种分子生物学实验方法。

Western blot(WB)是实验室中常见且重要的一种分子生物学实验方法。
具体的实验原理和实验步骤在前几期中已经做了详细的介绍,实验步骤大致分为:蛋白提取、蛋白定量、SDS-PAGE电泳、转膜、封闭、一抗孵育、清洗、二抗孵育、清洗、蛋白检测。步骤复杂,耗时长,容易出现各种问题,尤其对于新手来说更是一个挑战。为了让大家能够将这个实验做到完美,本期就简单向大家总结归纳了WB实验中常见的一些问题,并给出了解决方案,目的是为了让大家了解WB实验中的注意点和规范操作的必要性,同时也是方便大家在出现问题后能够及时分析出原因,调整实验方案,得到预期结果。
我们将常见问题总结归纳为背景高、条带形状异常、非特异性条带、没有条带或条带弱4大类,本期我们首先介绍背景高和条带形状异常这两种常见问题。
一、背景高

| 原因分析 | 建议解决方案 |
| 膜封闭不充分 | 延长封闭时间;更换更加合适的封闭液 |
| 一抗孵育浓度高 | 降低一抗稀释浓度,可减少非特异性条带 |
| 一抗孵育温度偏高 | 建议4℃过夜孵育 |
| 膜清洗不充分 | 可适当增加清洗次数和时间 |
| 膜在实验过程中干过 | 整个实验过程中保持膜湿润 |
| 曝光时间过长 | 根据条带背景,适当减少曝光时间 |
| 转膜液,封闭液等不新鲜或可能被污染 | 现配现用 |
二、条带形状异常
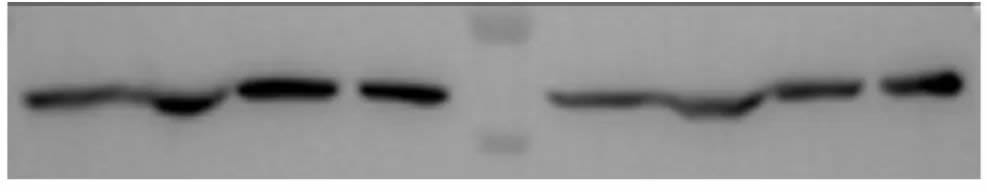
微笑条带
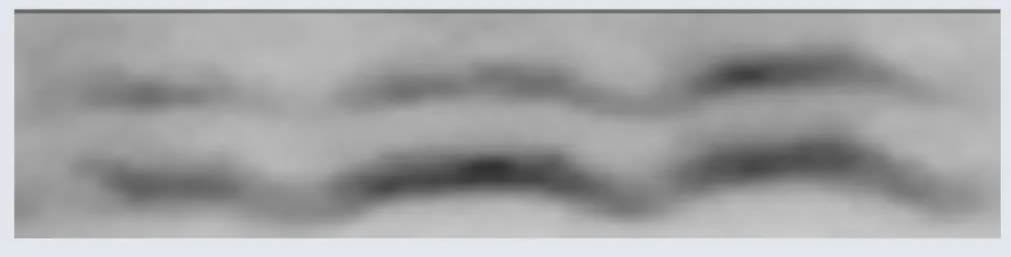
皱眉条带

哑铃条带

条带串孔

竖条纹条带

条带拖尾

条带变形
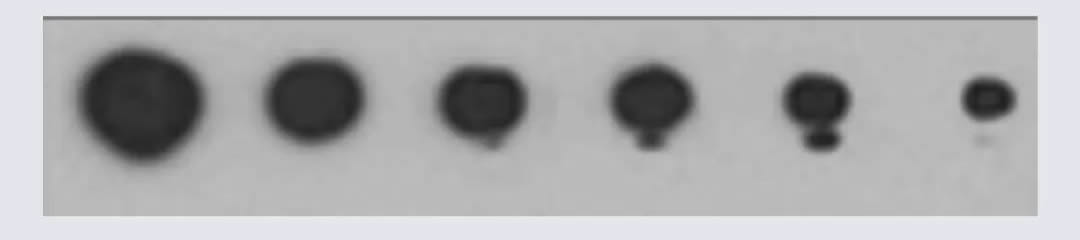
条带变形

条带上有白色圆圈

条带反白
| 条带类型 | 原因分析 | 建议解决方案 |
| 微笑条带(︶) | 电泳电流不均一 | 需更换电泳槽或两边的边缘孔不加样本 |
| 凝胶冷却不均匀 | 重新配制凝胶 | |
| 电泳速度过快 | 可减少电压等减慢电泳速度 | |
| 转膜温度过高 | 可在冷室或者冰浴中进行转膜 | |
| 皱眉条带(⌒) | 可能是凝胶和玻璃挡板底部有气泡,或者两边聚合不完全 | 可通过调整装置来避免该问题 |
| 哑铃条带 | SDS-PAGE胶配制时凝固的不均匀 | 需要重新配胶 |
| 样品可能含有过多杂质 | 样品使用前对其进行离心,以去除过多杂质 | |
| 条带串孔 | 上样量高 | 需降低上样量 |
| 制胶问题,分离胶和浓缩胶之间有间隙 | 重新配胶 | |
| 竖条纹条带 | 上样样品中存在不溶性颗粒 | 上样前离心去除颗粒 |
| 膜上的黑点和黑斑可能是封闭液溶解不完全或是封闭液放置过久 | 过滤封闭液或者更换封闭液 | |
| 条带拖尾 | 一抗浓度高,孵育时间久 | 降低一抗浓度和孵育时间 |
| 蛋白浓度高 | 降低上样量 | |
| 样品溶解不好 | 重新溶解样品,上样前可离心,优化蛋白提取的方法 | |
| 电泳液、转膜液使用次数过多 | 现配现用 | |
| 蛋白样品降解 | 提取蛋白是可加蛋白酶抑制剂,全程冰上操作 | |
| 分离胶浓度大 | 根据目的蛋白分析大小,选择合适浓度的分离胶 | |
| 条带变形 | 胶中有气泡或者不溶性颗粒 | 确保配胶试剂中无杂质 |
| 蛋白样品降解 | 提取蛋白时可加蛋白酶抑制剂,全程冰上操作 | |
| 条带上有白色圆圈 | 转膜时出现气泡 | 在转膜过程中要尽量去除气泡,使膜、滤纸和胶紧密结合 |
| 反白条带 | 一抗浓度过高,二抗上HRP催化活力太强,同时显色底物处于临界点,反应时间不长,将周围底物催化完,形成了空白HRP 结合物浓度过高 | 可降低一抗和二抗浓度,或者更换底物 |