温控技术特点在Western blot实验步骤中的重要性主要体现在抗原-抗体免疫反应和显影前的膜片浸泡(贮存)两方面。

Western blot 是对目的蛋白进行检测的一种实验方法,大致分为:蛋白提取、蛋白定量、SDS-PAGE电泳、转膜、封闭、抗原-抗体免疫反应(一抗孵育、二抗孵育)、蛋白检测。具体的步骤和原理前面已有介绍,本次的主题主要针对AW系列产品的技术特点进行详细介绍,主要分为温控、高通量、高回收率三大技术特点。结合仪器技术特点便于大家对本产品的应用有更深入的了解,这一期我们先介绍AW-12产品的温控技术特点在Western blot实验中的具体应用。
温控技术特点在Western blot实验步骤中的重要性主要体现在抗原-抗体免疫反应和显影前的膜片浸泡(贮存)两方面。
一 抗原-抗体免疫反应
也就是western blot实验步骤中的一抗孵育和二抗孵育。在这个步骤中抗体的选择、抗体的稀释比例、抗体的孵育时间以及温度对实验的结果都是十分的重要,每一个环节都不能出问题,否则都会严重影响实验结果,导致实验失败。
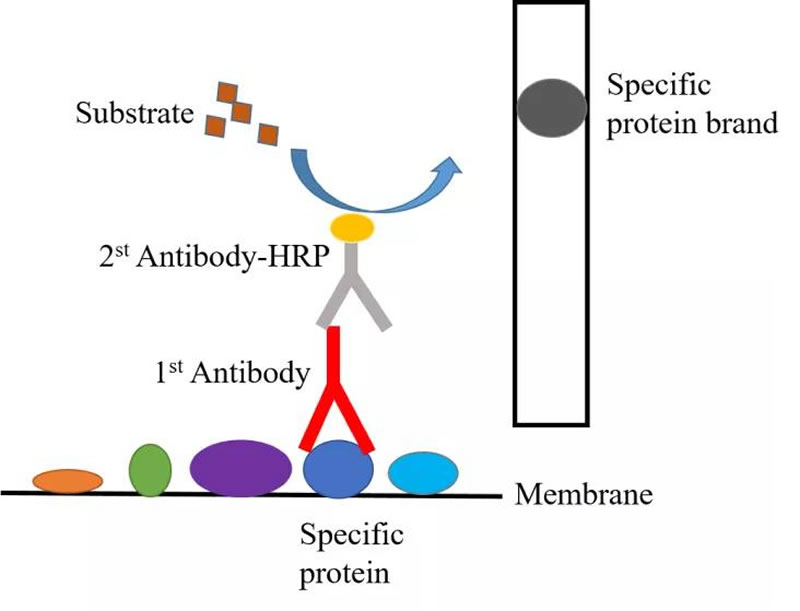
抗原-抗体免疫反应示意图
一抗孵育
一般我们会首选与目的蛋白特异性结合的单克隆抗体(即单抗),之前大多都倾向于选择国外的一些品牌,近来国产抗体也相继出现一些优秀的品牌可供选择。然而对于没有单抗的抗体则会选择有实验验证或有文献作为参考的多克隆抗体(即多抗)。一抗与目的蛋白表面的抗原表位结合,而膜表面的非特异性位点因为被封闭过程中牛奶的蛋白质所结合,因此与一抗的结合量很少,结合的抗体也会在一抗清洗时被去除。一抗孵育的温度和时间,最常用的有两种条件:1)4℃摇床过夜孵育,温度适宜,分子运动温和,一抗与目标蛋白结合充分;而且低温(4℃)条件下也可以提高抗体的回收利用率,节约实验成本。2)37℃摇床孵育1-2h,但温度越高,分子间的运动能力增强,出现非特异性结合的可能性就越高;同时孵育时间较短,也可能会导致一抗与目标蛋白结合不充分。但对于一些非常好用的抗体,这个孵育条件也是可以的,但是不利于抗体的回收利用,室温条件会大大降低抗体的活性,影响抗体的重复利用。
然而无论实验人员选择哪一种一抗孵育的时间和条件,AW-12都可以满足要求,AW-12具备了低温贮存、低温和室温孵育功能,低温贮存功能可以使贮存的抗体在实验过程中始终保持在低温状态,有利于维持抗体的活性;低温和室温孵育功能可根据实验人员的具体实验需求进行选择,时间和抗体是否回收也可根据需求自行设置,操作简单且十分人性化,完全满足实验人员对抗体孵育的各种要求。
二抗孵育
一抗结合之后,就是选择与一抗结合的二抗,而二抗蛋白结构被HRP(辣根过氧化物酶)标记,可与发光底物相结合,该底物极强的信号输出使得目的蛋白被检测到,因此得到显影结果。二抗孵育的一般条件是室温1h,为了防止二抗孵育和清洗时间过久导致HRP信号减弱,因此可以选择在低温条件下清洗二抗,AW-12只需要在二抗清洗步骤中将温度设为低温即可,也可选择在室温条件下清洗,根据实验需求进行选择即可。
二 膜片浸泡(贮存)
抗原-抗体免疫反应完成后,如果不及时进行显色曝光,就需要将膜片浸泡在清洗液(PBST/TBST)中并保存在低温环境中,保持膜片上的抗体活性和二抗上HRP的信号。如果是手工操作实验,最后膜片浸泡时需要将膜片孵育盒放到4℃冰箱中保存,等待实验人员显色曝光;而使用AW-12进行实验时,我们仪器默认的程序设置是在膜片浸泡时始终保持在低温状态,直到实验人员将膜片拿出显色曝光。
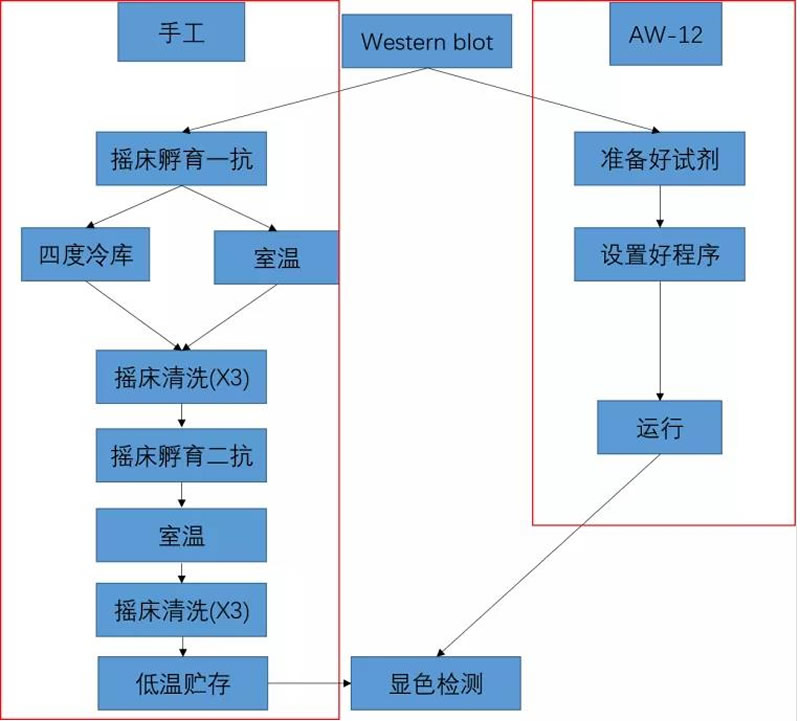
抗原-抗体免疫反应步骤手工与AW-12对比图
从上述对比图也可以明显看出使用AW-12来完成抗原-抗体免疫反应至显色曝光这一段实验流程,不仅可以大大节约实验人员的时间,AW-12的低温贮存功能和低温、室温孵育功能更能灵活的满足实验的各种需求。